História da Tabela Periódica
Química
A
tabela periódica é um modelo que agrupa todos os elementos químicos conhecidos
e apresenta algumas de suas características. Atualmente, a tabela periódica
possui 118 elementos químicos.
Evolução da Tabela Periódica
O
modelo de tabela periódica que conhecemos atualmente, foi proposto pelo químico
russo Dmitri Mendeleiev (1834-1907), no ano de 1869.
A
finalidade fundamental de criar uma tabela era para facilitar a classificação,
a organização e o agrupamento dos elementos químicos conforme suas
propriedades.
Muitos
estudiosos já tentavam organizar estas informações e, portanto, muitos modelos
anteriores foram apresentados.
Da
Grécia Antiga vieram as primeiras tentativas de organizar os elementos
conhecidos. Empédocles foi um filósofo grego que falou da
existência de quatro "elementos": água, fogo, terra e ar.
Posteriormente, Aristóteles fez
a primeira organização desses elementos e lhes associou algumas
"propriedades" como úmido, seco, quente e frio.
Antoine
Lavoisier (1743-1794) observou que por meio da eletrólise,
a água se decompunha em hidrogênio e oxigênio. Classificou então as substâncias
encontradas em elementares por não conseguir dividi-las em substâncias mais
simples.
Ele
identificou alguns dos primeiros elementos químicos e, em 1789, organizou uma
lista de 33 elementos divididos em conjuntos de substâncias simples, metálicas,
não-metálicas e terrosas, mas não conseguiu estabelecer uma propriedade que os
diferenciasse.
Johann
W. Döbereiner (1780-1849) foi um dos primeiros a observar uma
ordem para organizar os elementos químicos. Como no início do século XIX
valores aproximados de massa atômica para alguns elementos haviam sido
estabelecidos, ele organizou grupos de três elementos com propriedades
semelhantes.
 Tríades de
Döbereiner
Tríades de
Döbereiner
O
modelo de classificação proposto por Döbereiner chamou bastante atenção da
comunidade científica na época. Ele sugeriu uma organização baseada em tríades,
ou seja, os elementos eram agrupados em trios conforme as suas propriedades
semelhantes.
A massa atômica do
elemento central era a média das massas dos outros dois elementos. Por exemplo,
o sódio tinha um valor aproximado de massa que correspondia a média das massas
de lítio e potássio. Entretanto, muitos elementos não podiam ser agrupados
dessa forma.
Alexandre-Emile
B. de Chancourtois (1820-1886),
geólogo francês, organizou 16 elementos químicos por ordem crescente de massa
atômica. Para isso, utilizou um modelo conhecido por Parafuso Telúrico.
No
modelo proposto por Chancourtois, ocorre a distribuição das informações na
base, em forma de cilindro, alinhando verticalmente os elementos com
propriedades semelhantes.
 Modelo do Parafuso Telúrico
Modelo do Parafuso Telúrico
John
Newlands (1837-1898) também desempenhou papel
fundamental. Ele criou a lei das oitavas para os elementos químicos.
Suas
observações mostraram que, organizando os elementos por ordem crescente de
massa atômica, a cada oito elementos as propriedades se repetiam, estabelecendo
assim, uma relação periódica.
 Tabela de
Newlands
Tabela de
Newlands
O
trabalho de Newlands ainda era restrito, pois essa lei se aplicava até o
cálcio. Entretanto, seu pensamento foi precursor das ideias de Mendeleiev.
Julius
Lothar Meyer (1830-1895), baseando-se principalmente nas
propriedades físicas dos elementos, fez uma nova distribuição segundo as massas
atômicas.
Ele
observou que entre elementos consecutivos, a diferença das massas era constante
e concluiu a existência de relação entre massa atômica e propriedades de um
grupo.
Através
do estudo proposto por Meyer foi possível comprovar a existência de periodicidade,
ou seja, ocorrência de propriedades semelhantes em intervalos regulares.
Dmitri
Mendeleiev (1834-1907), em 1869, estando na Rússia, teve a
mesma ideia que Meyer, que realizava seus estudos na Alemanha. Ele, de forma
mais meticulosa, organizou um quadro periódico, onde os 63 elementos químicos
conhecidos estavam dispostos em colunas com base em suas massas atômicas.
 Tabela periódica proposta por Mendeleiev
Tabela periódica proposta por Mendeleiev
Além
disso, deixou espaços vazios na tabela para os elementos que ainda não eram
conhecidos. Mendeleiev era capaz de descrever algumas informações dos elementos
faltantes com base na sequência que elaborou.
O
Trabalho de Mendeleiev foi o mais completo até então realizado, pois organizou
os elementos conforme suas propriedades, reuniu um grande número de informações
de maneira simples e constatou que novos elementos seriam descobertos, deixando
espaços para inseri-los na tabela.
Até
então, nada se sabia a respeito da constituição dos átomos, mas a organização
proposta por Meyer-Mendeleiev originou inúmeras investigações para justificar a
periodicidade dos elementos e constitui a base da atual Tabela Periódica.
Henry
Moseley (1887-1915), em 1913, fez importantes
descobertas, estabelecendo o conceito de número atômico.
Com o desenvolvimento de estudos para explicar a estrutura dos átomos, um novo
passo foi dado para organização dos elementos químicos.
A
partir de seus experimentos, ele atribuiu números inteiros a cada elemento e,
posteriormente, foi constatada a correspondência ao número de prótons no núcleo do
átomo.
Moseley
reorganizou a tabela proposta por Mendeleiev de acordo com os números atômicos,
eliminando algumas falhas da tabela anterior e estabeleceu o conceito de
periodicidade da seguinte forma:
Muitas
propriedades físicas e químicas dos elementos variam periodicamente na
sequência dos números atômicos.
De
fato, todos os modelos propostos, de alguma forma, contribuíram para as
descobertas sobre os elementos químicos e suas classificações.
Além
disso, foram fundamentais para que chegasse ao modelo atual de tabela periódica
que apresenta 118 elementos químicos.
Veja também: Famílias da tabela periódica
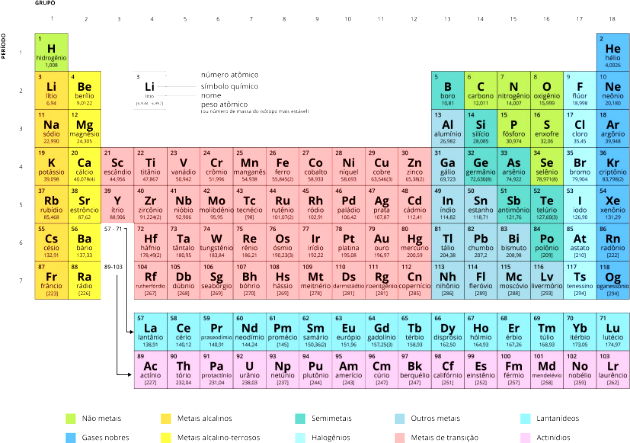
Tabela Periódica Completa e Atualizada
A
tabela periódica recebe esse nome em relação à periodicidade, ou seja, os
elementos estão organizados de forma que suas propriedades se repetem de forma
regular.
Conheça
a Tabela Periódica completa
e atualizada:

A distribuição eletrônica refere-se
ao modo em que os elétrons estão distribuídos nas camadas ou níveis de
energia que ficam ao redor do núcleo do átomo. Por exemplo, abaixo temos
os elétrons do berílio. Ele possui 4 elétrons no total, distribuídos em duas
camadas eletrônicas.
Distribuição eletrônica em camadas
Após
terem surgido vários modelos atômicos, o modelo de Bohr sugeriu a organização
da eletrosfera em órbitas.
Os
elétrons se organizam e distribuem-se pelas camadas eletrônicas, estando uns
mais próximos do núcleo e outros mais distantes.

Quanto mais distantes do núcleo, mais energia têm os elétrons
Então,
surgiram as 7 camadas eletrônicas (K, L, M, N, O, P e Q), as quais são
representadas pelas linhas horizontais numeradas de 1 a 7 na tabela periódica.
Os
elementos que constam nas mesmas linhas apresentam o mesmo número máximo de
elétrons e também os mesmos níveis de energia.
Com
isso, é possível observar que os elétrons encontram-se em níveis e sub-níveis
de energia. Assim, cada um possui uma determinada quantidade de
energia.





0 Comentários