Carbono

O carbono é um dos elementos mais versáteis que encontramos na natureza, em razão de sua larga aplicação industrial e, principalmente, pela presença em composições celulares e compostos naturais. Apesar da associação negativa com o aquecimento global, o carbono é o elemento-base da Química Orgânica, sendo responsável pela maioria dos compostos existentes na natureza.
Onde é encontrado?
O carbono está presente, em maior parte, em compostos orgânicos, que são compostos derivados desse elemento, sejam eles naturais (como na composição de proteínas, na estrutura do DNA, nos minerais e ainda em combustíveis fósseis e nos biocombustíveis), sejam sintéticos (por exemplo, fibras sintéticas de tecidos, fármacos, plásticos, borracha etc.).
O carbono também aparece ligado ao oxigênio na composição do gás carbônico (CO2), presente na atmosfera e dissolvido na água. Apesar da associação negativa com o efeito estufa, o carbono faz parte de ciclos vitais, como da fotossíntese e da respiração celular.
O carbono apresenta alótropos, que são substâncias simples diferentes formadas pelo mesmo elemento químico. Existem pelo menos sete alótropos do carbono. Os mais conhecidos e que aparecem com mais frequência no nosso cotidiano é a grafite (alfa e beta) e o diamante. Mas ainda existem os fulerenos e os nanotubos, que são materiais sintéticos feitos exclusivamente de carbono.
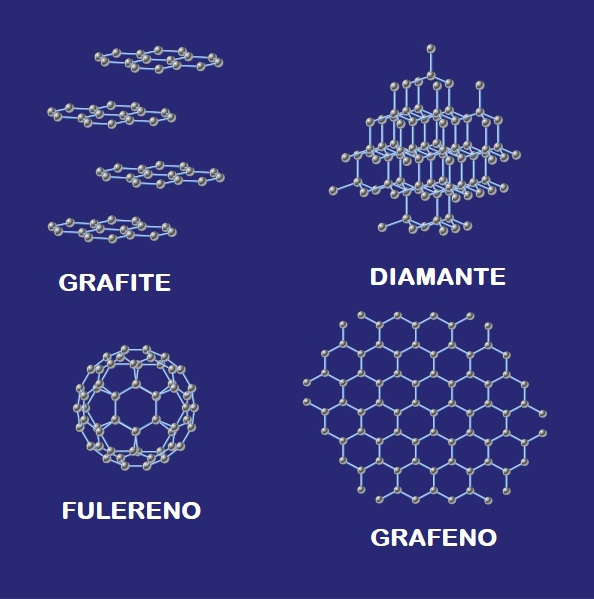
Diferença nas estruturas dos principais alótropos do carbono: grafite, diamante, fulereno e grafeno.
Para que serve?
Devido à facilidade em formar compostos, o carbono possui várias utilizações, que vão desde usinas de produção de energia até a fabricação de joias. Na forma de combustíveis fósseis, o carbono é utilizado para abastecer máquinas em indústrias e usinas, além de abastecer meios de transporte.
Na metalurgia, o carbono é adicionado a ligas metálicas de aço. O isótopo C-14, por sua vez, é utilizado na datação de materiais orgânicos antigos encontrados em sítios arqueológicos.
Seus alótropos também possuem diversas utilizações: o diamante é utilizado na fabricação de joias e também em máquinas de corte devido à sua dureza. O grafite é utilizado na fabricação de lápis e objetos de escrita e na fabricação de eletrodos e de lubrificantes sólidos. Os nanotubos e fulerenos são objetos de estudos com o intuito de produção de novos materiais.
Características
As características físicas desse elemento variam de acordo com sua forma alotrópica. Por exemplo, o diamante é totalmente transparente, enquanto o grafite é preto e opaco.
Em relação à condutividade elétrica, apenas o grafite é um bom condutor, já o restante apresenta boa condutividade térmica em condições ambientes de temperatura e pressão.
Sobre o estado físico, todos os alótropos são sólidos em temperatura ambiente.
Curiosidades
Algumas curiosidades sobre o carbono e seus compostos:
- Cerca de 20% do peso dos organismos vivos é referente ao carbono.
- O carbono é o 4° elemento mais abundante no Universo.
- O grafeno, um dos alótropos do carbono, é o material mais fino e mais forte já conhecido.
- Existem mais compostos que possuem carbono em sua fórmula do que os que não contêm.
- Apesar de poder ser quebrado, o diamante é o material de maior dureza já conhecido, podendo riscar qualquer outro material.
- O isótopo do carbono C-12 é utilizado pela União Internacional de Química Pura e Aplicada (IUPAC) desde 1977, como referência para calcular as massas atômicas dos outros elementos químicos.
- O diamante é um material cobiçado por muitos devido ao seu brilho e grau de dureza.

O diamante, um dos alótropos do carbono, é um dos materiais mais valiosos do mundo.





0 Comentários