Alotropia

A alotropia se manifesta em alguns elementos químicos e é representada pela possibilidade de existirem diferentes substâncias simples para um mesmo elemento, as quais são conhecidas como alótropos.
Os alótropos se diferem pela organização dos átomos na estrutura da molécula, característica que fornece significativas diferenças nas propriedades físico-químicas para os alótropos de um mesmo elemento.
O exemplo de alotropia mais conhecido é a que ocorre com o carbono. Esse elemento possui diversos alótropos, sendo os mais estáveis o diamante, o grafite e os fulerenos. Outros elementos químicos também manifestam a alotropia, como o enxofre, o fósforo e o oxigênio.
Leia também: Substâncias e misturas — qual a diferença?
Resumo sobre alotropia
Alotropia é uma propriedade manifestada por alguns elementos químicos que conseguem formar diferentes substâncias simples.
Os alótropos de um mesmo elemento químico possuem diferentes estruturas moleculares e, por isso, manifestam diferentes propriedades físico-químicas.
O diamante e o grafite são os alótropos do carbono mais conhecidos.
Os outros alótropos para o carbono são os fulerenos, o grafeno, os nanotubos de carbono e, inclusive, as formas amorfas, como o coque e o carvão.
O fósforo possui dois alótropos principais, o fósforo vermelho e o fósforo branco.
O oxigênio possui dois alótropos bastante conhecidos, o gás oxigênio e o ozônio.
O enxofre manifesta uma alotropia diversa. Seus dois principais alótropos são o enxofre monoclínico e o enxofre rômbico, ambos possuem oito moléculas de enxofre dispostas em uma organização espacial diferente.
Videoaula sobre alotropia
O que é alotropia?
A alotropia é uma propriedade em que o mesmo elemento químico existe sob a forma de duas ou mais substâncias simples diferentes. Vale lembrar que substâncias simples são aquelas formadas por um único elemento químico. Essas espécies distintas são chamadas de alótropos.
Os alótropos de um elemento se diferem pela sua estrutura. Isso significa que os átomos daquele elemento se ligam de diferentes formas em cada uma das espécies alotrópicas. Em razão dessa diferença fundamental, os alótropos podem apresentar propriedades físicas distintas, como densidade, pontos de fusão, volume, cor, entre outras.
Os conjuntos de alótropos mais conhecidos são os do grafite e do diamante. Ambas as substâncias são compostas apenas por carbono, e os carbonos da estrutura de cada uma estão unidos entre si de diferentes formas. Essa diferença, aparentemente sutil, é responsável por propriedades físico-químicas completamente diferentes para o grafite e para o diamante.

A alotropia se refere a diferentes formas de um elemento em um mesmo estado da matéria ou fase. Assim, as transições entre sólido, líquido e gasoso não são consideradas como alotropia.
Alguns alótropos continuam existindo, mesmo em diferentes estados da matéria. É o que ocorre para os alótropos do oxigênio ― o dioxigênio (O2) e ozônio (O3) ―, os quais continuam existindo mesmo com a ocorrência de mudança de fase. Já os alótropos do fósforo se convertem para uma única forma molecular quando passam do estado sólido para o líquido.
A alotropia é diferente do fenômeno de polimorfismo. Ela se refere às substâncias simples, e o polimorfismo trata de distintas estruturas químicas para compostos, substâncias formadas por mais de um elemento químico.
O que são alótropos?
Os alótropos são substâncias simples diferentes formadas por um único elemento químico.
Por exemplo, o oxigênio possui dois alótropos: o gás oxigênio (O2) e o ozônio (O3). Ambos são substâncias simples, pois são formados apenas pelo elemento oxigênio, mas possuem moléculas diferentes.
Os alótropos de um elemento podem existir em diferentes condições de estabilidade, sendo possível um deles ser mais estável energeticamente do que os demais. Em algumas situações, como essa, é possível a transformação do alótropo menos estável para a forma alotrópica de maior estabilidade, como ocorre com os alótropos do fósforo. Tal processo de transição pode ocorrer de forma reversível ou irreversível.
Leia também: Fenômenos físicos e químicos — qual é a diferença?
Alotropia do carbono
O carbono pode formar diversos alótropos diferentes, como o diamante, o grafite, o carvão, o grafeno, o fulereno, entre outros.
O diamante é um material cristalino, incolor, de altíssima dureza e elevada temperatura de fusão. Nesse alótropo, cada átomo de carbono forma quatro ligações simples com outros átomos de carbono, mantendo hibridização sp3 e constituindo uma estrutura tetraédrica extensa. As fortes ligações simples carbono-carbono e a rede cristalina tetraédrica formada explicam as características de elevada dureza e temperatura de fusão para o diamante.
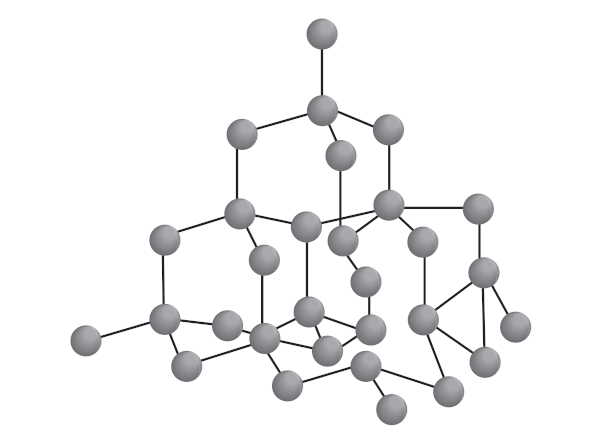
O grafite é um sólido cinza de baixa dureza, com propriedades lubrificantes, por ser escorregadio, e que conduz corrente elétrica. Essas propriedades, muito diferentes daquelas observadas no diamante, são derivadas de sua estrutura organizada em camadas bidimensionais.
Nesse alótropo, cada átomo de carbono está ligado a outros três átomos, constituindo uma camada de anéis de seis membros e mantendo hibridização sp2, em um arranjo trigonal planar. O empilhamento de várias camadas de átomos de carbono sp2 forma a estrutura do grafite.
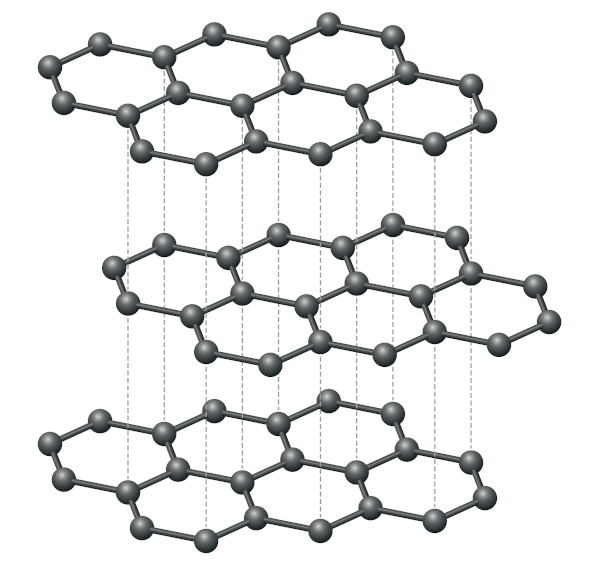
No grafite, as ligações sigma e pi entre carbonos dentro das camadas são muito fortes, e as interações intermoleculares que se estabelecem entre as camadas são de fraca intensidade. As fracas forças de interação entre as camadas são responsáveis por tornar o grafite macio e escamoso, explicando sua propriedade lubrificante.
O coque, o carvão e o negro de fumo são alótropos do carbono cujas estruturas possuem caráter amorfo, isto é, os átomos de carbono se combinam de forma variada, não constituindo uma estrutura cristalina.
Recentemente, novos alótropos de carbono vêm sendo conhecidos. Uma dessas novas formas são os fulerenos, um grupo de moléculas em formato esférico compostas por dezenas de átomos de carbono. Nessas estruturas, os átomos de carbono mantêm três ligações com outros átomos de carbono, estabelecendo fortes ligações de hibridização sp2.
O buckminsterfulereno é um dos representantes dos fulerenos, sendo formado por 60 átomos de carbono organizados em anéis de cinco e seis membros.
Os fulerenos foram identificados na fuligem derivada do aquecimento do grafite em altas temperaturas e são a terceira espécie alotrópica do carbono mais estável. Em razão de sua estrutura singular, as propriedades físico-químicas dos fulerenos também se tornam únicas, podendo ser aplicados em diversas áreas. Na medicina, um dos principais usos dessas estruturas esféricas tem sido o transporte direcionado de fármacos dentro de organismos vivos.

O grafeno e os nanotubos de carbono são alótropos de carbono que vêm sendo muito estudados em laboratórios de pesquisa em razão de suas propriedades condutoras e mecânicas, destacando-se por serem excelentes materiais para aplicação na área tecnológica e de nanotecnologia.
O grafeno, descoberto em 2003, nada mais é do que uma única camada de grafite, possuindo a espessura de um átomo. Os átomos de carbono mantêm ligações com outros três átomos de carbono, formando uma rede de anéis de seis membros.
Uma das formas de isolar o grafeno é por meio da esfoliação do grafite. O grafeno se destaca pela elevada condução de calor e de eletricidade e pela sua resistência mecânica. Sua descoberta rendeu o prêmio Nobel de Física em 2010.
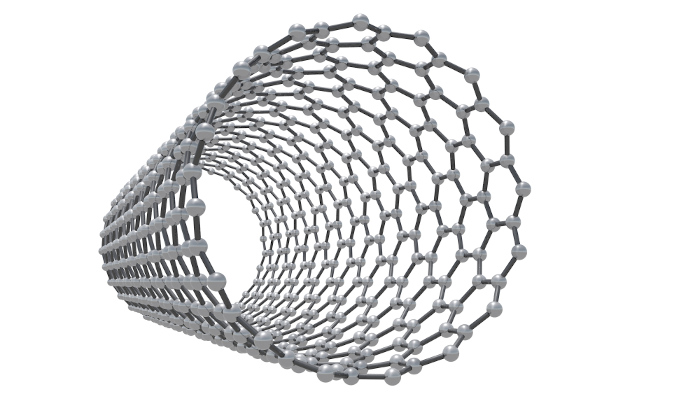
Os nanotubos de carbono são estruturas cilíndricas que podem ser entendidas como folhas de grafeno enroladas, mas não necessariamente formadas assim. Os átomos de carbono mantêm hibridização sp2, formando três ligações e anéis de seis membros ao longo de uma estrutura bidimensional.
Os nanotubos de carbono são extremamente fortes, de elevada dureza e leves, tornando-se um material interessante para usos que necessitam de resistência mecânica. Também apresentam condutividade significativa.
O grafeno, os nanotubos de carbono e os fulerenos são nanomateriais em razão de suas dimensões em escala nanométrica.
Alotropia do fósforo
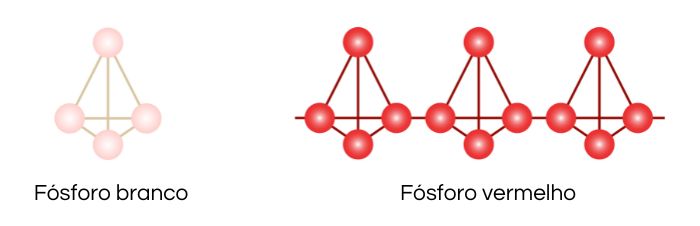
O fósforo pode apresentar muitas formas alotrópicas, sendo as mais comuns o fósforo vermelho e o fósforo branco.
O fósforo branco é formado por quatro átomos de fósforo, os quais se organizam em um tetraedro regular. Essa espécie se mantém como moléculas de P4 nos estados sólido, líquido e gasoso e é considerada tóxica.
O fósforo branco é um sólido de aspecto ceroso que derrete em temperatura relativamente baixa, cerca de 44 °C, e entra em ebulição em 280 °C. Possui caráter apolar, sendo insolúvel em água. É reativo se exposto ao ar atmosférico e, por isso, é armazenado imerso em solventes polares, como a água.
O fósforo branco pode se converter no fósforo vermelho por aquecimento entre 270 ºC e 300 °C, na ausência de ar. O alótropo fósforo vermelho é denso, mais estável e menos reativo do que o fósforo branco. Isso garante mais segurança em seu manuseio. Além disso, possui baixa toxicidade e maior temperatura de fusão, em aproximadamente 600 °C.
O fósforo vermelho possui propriedade polimérica, conseguindo formar extensas cadeias pela repetição de tetraedros P4, unidos por ligações entre átomos de fósforo.
Alotropia do oxigênio
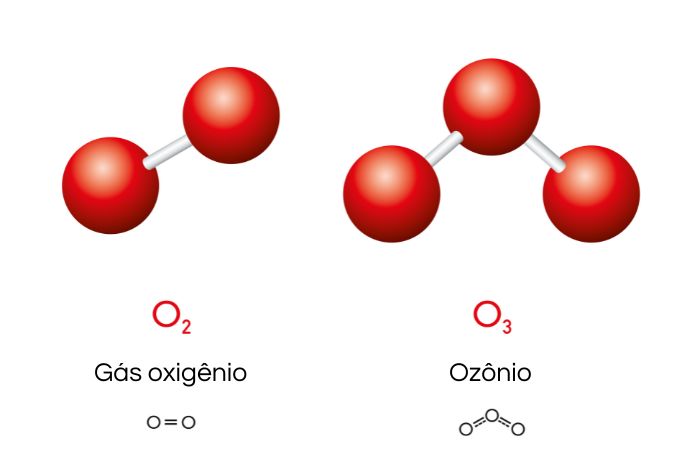
O oxigênio apresenta dois principais alótropos, o dioxigênio (O2) e o ozônio (O3).
O O2, também conhecido como gás oxigênio, é o gás que respiramos, compondo cerca de 21% da atmosfera terrestre. É incolor e inodoro. O gás oxigênio é empregado como fonte energética por organismos aeróbicos durante o processo de respiração celular.
O O3 é um gás considerado perigoso, possui odor forte e caraterístico. Possui uma coloração azulada e bastante intensa quando está sob a forma líquida ou sólida. É termodinamicamente menos estável do que o O2, sendo mais reativo do que a forma diatômica.
O O3 é o gás constituinte da camada de ozônio, atuando como uma barreira protetora do planeta contra a radiação ultravioleta (UV) proveniente do Sol. O ozônio é constantemente gerado na atmosfera pela incidência de radiação UV e por descargas elétricas sobre moléculas de O2. Pequenas quantidades de O3 podem ser geradas durante o funcionamento de motores elétricos, fotocopiadoras e impressoras a laser. O O3 também possui função antimicrobiana.
O alótropo mais recente do oxigênio identificado é o tetraoxigênio (O4), espécie sólida de coloração vermelha, obtida do gás oxigênio em condição de elevada pressão. O O4 ainda é pouco conhecido, mas se destaca pela considerável ação oxidante. Por isso, está sendo estudado para aplicações que necessitem de elevada energia, como combustíveis de aeronaves espaciais.
O oxigênio ainda apresenta outras formas alotrópicas no estado sólido, obtidas por meio de aplicação de altíssima pressão. Uma delas é o O8, um sólido vermelho-escuro, com propriedades metálicas e que se assemelha aos outros elementos do grupo 16 que possuem maior número atômico, como o selênio e o telúrio.
Alotropia do enxofre
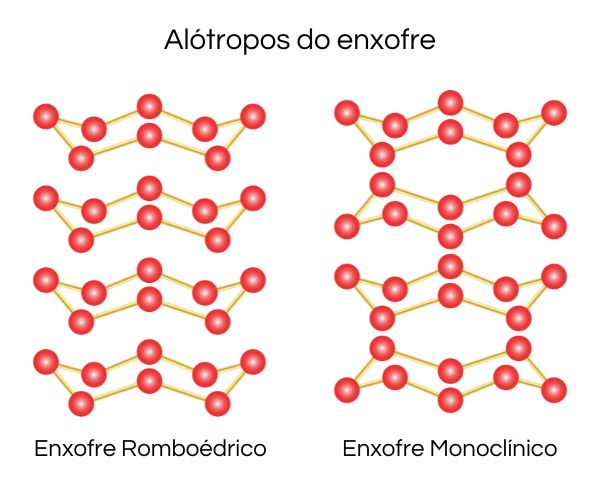
A alotropia do enxofre é vasta, existindo muitos alótropos diferentes para esse elemento. Na natureza, são encontradas as formas alotrópicas de enxofre monoclínico e enxofre rômbico (ou enxofre amarelo), ambas formadas por moléculas de oito átomos de enxofre.
Nessas estruturas, cada átomo de enxofre estabelece duas ligações simples covalentes com átomos de enxofre vizinhos e se diferencia pela disposição especial dos átomos, como pode ser observado na imagem abaixo.






0 Comentários